Sifat Fisika dan Kimia Unsur Periode Empat secara khusus. Untuk penjelasannya, kita bagi menjadi dua bagian yaitu pertama tentang Sifat Fisika Unsur Periode Empat dan kita lanjutkan yang kedua yaitu Sifat Kimia Unsur Periode Empat.
Sifat Fisika Unsur Periode Empat
Sifat Kimia Unsur Periode Empat
a. Mempunyai Berbagai Macam Bilangan Oksidasi
Perhatikan konfigurasi elektron dan bilangan oksidasi unsur transisi periode empat pada Tabel berikut ini:Unsur transisi memiliki elektron pada orbital $d$. Energi elektron dalam orbital $d$ hampir sama besar. Untuk mencapai kestabilan, unsur-unsur ini membentuk ion dengan cara melepaskan elektron dalam jumlah yang berbeda. Oleh karena itu unsur-unsur ini mempunyai dua macam bilangan oksidasi atau lebih dalam senyawanya.
b. Banyak Senyawanya Bersifat Paramagnetik
Sifat magnetik suatu zat apakah terdiri atas atom, ion atau molekul ditentukan oleh struktur elektronnya. Interaksi antara zat dan medan magnet dibedakan menjadi dua, yaitu diamagnetik dan paramagnetik. Zat paramagnetik tertarik oleh medan magnet, sedangkan zat diamagnetik tidak. Banyak unsur transisi dan senyawaannya bersifat paramagnetik. Hal ini disebabkan adanya elektron yang tidak berpasangan. Perkiraan momen magnetik yang disebabkan oleh spin elektron tak berpasangan ditentukan dengan persamaan berikut:$ \begin{align} \mu = \sqrt{n(n+2)} \end{align} $
Keterangan:
$ \mu \, $ = momen magnetik dalam Bohr Magneton
$ n \, $ = jumlah elektron yang tak berpasangan
1 Bohr magneton (1 B.M) = 9,273 erg/gauss.
Perhatikan harga momen magnetik pada tabel berikut:
Makin banyak jumlah elektron yang tidak berpasangan, makin besar momen magnetiknya sehingga makin besar sifat paramagnetik. Hubungan ini dapat kita buat grafik seperti pada gambar berikut:
Berdasarkan grafik ini, dapat kita lihat bahwa dalam satu periode dari kiri ke kanan hingga pada ion Mn$^{2+}$ momen magnetiknya makin besar, selanjutnya makin berkurang secara teratur. Begitu juga dengan sifat paramagnetiknya.
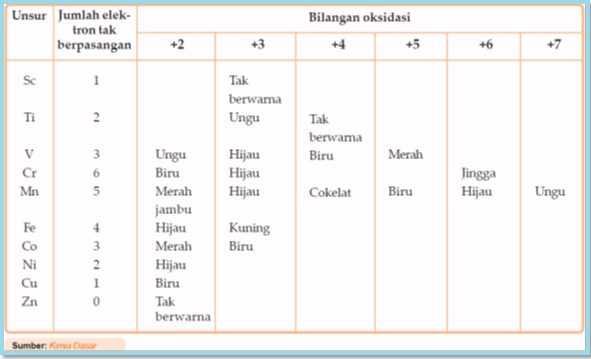
c. Ion Unsur Transisi Berwarna
Berbeda dengan unsur-unsur alkali dan alkali tanah, pada umumnya ion unsur transisi membentuk senyawa berwarna. Beberapa di antaranya dapat dilihat pada Tabel berikut:Ion-ion dengan tingkat oksidasi yang berbeda mempunyai warna yang berbeda. Misalnya, perhatikan warna ion unsur mangan pada Tabel di atas.
Terjadinya warna pada ion unsur transisi karena ion unsur transisi mempunyai elektron yang tidak berpasangan pada subkulit 3d dan elektron-elektron itu terpecah dengan tingkat energi yang berbeda. Elektron-elektron itu tereksitasi dari tingkat energi yang lebih rendah ke tingkat energi yang lebih tinggi dengan menyerap energi. Perubahan tingkat energi ini setara dengan energi cahaya tampak.Adapun pada ion zink tidak berwarna, karena orbital d sudah penuh elektron sehingga tidak terjadi perpindahan energi pada orbital d.
d. Unsur-Unsur Transisi dapat Membentuk Senyawa Kompleks (Senyawa Koordinasi)
Senyawa koordinasi terdiri atas ion logam positif yang disebut juga atom pusat dan sejumlah gugus koordinasi yang disebut ligan. Ion positif bertindak sebagai asam Lewis dan ligan merupakan basa Lewis. Pada umumnya kation yang dapat membentuk senyawa kompleks adalah ion-ion unsur transisi, namun dikenal pula beberapa senyawa koordinasi unsur representatif seperti Mg(III), Ca(II), Al(III), Pb(II), Sn(II), Sn(IV), dan Sb(III).Ligan yang merupakan basa Lewis sekurang-kurangnya harus mempunyai sepasang elektron bebas dalam orbital ikatan. Perbandingan besarnya ligan dan atom pusat menentukan jumlah ligan maksimum yang dapat diikat.
Jumlah ikatan kovalen koordinasi yang dapat terbentuk pada pembentukan kompleks disebut bilangan koordinasi dari ion pusat. Contohnya ion Cu$^{2+}$ mempunyai bilangan koordinasi 4 dalam [Cu(H$_2$O)$_4$]$^{2+}$, [Cu(NH$_3$)$_4$]$^{2+}$, dan dalam [CuCl$_4]^{2-}$. Ion Fe$^{3+}$ mempunyai bilangan koordinasi 6 dalam [Fe(H$_2$O)$_6]^{3+}$, [FeF$_6]^{3+}$, dan dalam [Fe(CN)$_6]^{3-}$. Adapun Ag$^+$ mempunyai bilangan koordinasi 2 dalam [Ag(NH$_3)_2]^+$, dan dalam [Ag(CN)$_2]^-$.
Demikian pembahasan materi Sifat Fisika dan Kimia Unsur Periode Empat.





Tidak ada komentar:
Posting Komentar