Beberapa asam-asam oksi selama ini dituliskan secara ringkas, saking ringkasnya jika tidak paham betul membuat siswa menjadi salah mengartikan. Mungkin penyebabnya guru juga salah dalam memahami konsep penulisan asam oksi itu sendiri. Untuk itu sebaiknya sejak awal siswa sudah dikenalkan dengan cara menuliskan asam-asam oksi yang sedikit berbeda dari yang mungkin selama ini diterapkan. Tujuannya adalah agar mudah dipahami ketika suatu reaksi kimia itu melibatkan asam-asam oksi. Cara penulisan asam-asam oksi yang mudah dipahami ini berangkat dari bagaimana struktur Lewis dari suatu asam oksi itu terjadi.
Misalnya pada H2SO4, jika tidak dipahami dengan baik siswa bisa saja mengira bahwa atom hidrogen itu berikatan langsung pada atom S, nyatanya tidak demikian. Pada HNO3, bisa jadi siswa berpikir bahwa atom H juga terikat langsung pada atom N, nyatanya bukan begitu. Pada H3PO4 dan H3PO3 kondisinya mungkin juga sama, tidak sedikit yang kurang benar memahaminya. Untuk H3PO4, H3PO3, H3PO2 sedikit penjelasannya pernah ditulis di sini.
 |
| Sumber: Principles of Modern Chemistry 7th Edition (page 686) Oleh David W. Oxtoby, H. Pat Gillis, Laurie J. Butler |
Meskipun alternatif penulisan rumus asam oksi ini tidak keliru masih juga memungkinkan siswa mengira bahwa Cl(OH), PO(OH)3, SO2(OH)2 bukanlah suatu senyawa asam melainkan suatu basa, kalau saja siswa selama ini dikenalkan bahwa basa itu terdapat OH di belakang rumus senyawanya. Apalagi kalau selama ini dibenak siswa terpatri untuk asam selalu ditandai dengan adanya atom H di depan rumus senyawanya dengan perkecualian hanya CH3COOH saja asam yang letak atom H-nya berada di belakang.
Berikut ini adalah tabel penulisan asam-asam oksi yang diadaptasi dari wikipedia.org.
Asam oksi di sini dikelompokkan menjadi 4 jenis dengan rumus umum:
- X(OH)m, contohnya Cl(OH) atau HClO
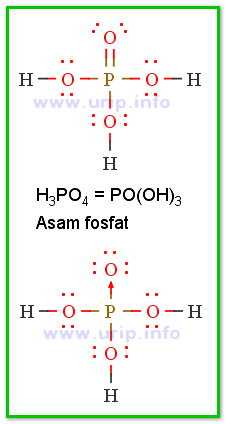
- XO(OH)m, contohnya PO(OH)3 atau OP(OH)3 atau H3PO4
- XO2(OH)m, contohnya SO2(OH)2 atau O2S(OH)2 atau H2SO4
- XO3(OH)m, contohnya ClO3(OH) atau O3Cl(OH) atau HClO4
Beberapa asam oksi dari nitrogen:





Beberapa asam oksi dari P (fosfor):
Beberapa asam oksi dari S (belerang):
Beberapa asam oksi dari klorin:
Beberapa asam oksi dari bromin:
Beberapa asam oksi dari iodin:
Beberapa asam oksi dari krom
Beberapa asam oksi dari Mn (Mangan):
Demikian, mohon jika ada kekurangtepatan dalam penulisan rumus dan struktur untuk dikoreksi. Terima kasih.






















Tidak ada komentar:
Posting Komentar