Beberapa soal tentang menentukan orbital hibrida sering ditampilkan dalam struktur molekul ala Lewis (Struktur Lewis). Ini akan mudah untuk diperkirakan orbital hibrida apakah yang dimiliki oleh suatu atom yang ditunjuk. Sedikit berbeda jika tidak ditampilkan struktur molekulnya dan ini dapat menggunakan trik yang pernah ditulis dalam blog ini. Petunjuk singkatnya adalah dengan menghitung jumlah macam ikatan pada struktur molekul.
Dimisalkan X adalah jumlah ikatan yang ada dan Y adalah jumlah pasangan elektron bebas (PEB), jika hasil:
X + Y = 2 (1s + 1p) orbital hibridanya sp,
X + Y = 3 (1s + 2p) orbital hibridanya sp2,
X + Y = 4 (1s + 3p) orbital hibridanya sp3,
X + Y = 5 (1s + 3p + 1d) orbital hibridanya sp3d,
X + Y = 6 (1s + 3p + 2d) orbital hibridanya sp3d2,
X + Y = 7 (1s + 3p + 3d) orbital hibridanya sp3d3.
Contoh Soal #1:
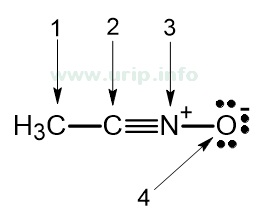
Tentukan orbital hibrida pada atom yang ditunjuk dengan nomor 1, 2, 3, 4 pada struktur molekul berikut:
Pembahasan #1:
- Atom C memiliki 4 ikatan singel (1 ikatan C–C dan 3 ikatan C–H)
→ anggap ada 1s + 3p → orbital hibrida C adalah sp3. - Atom C memiliki 1 ikatan singel (ikatan C–C) dan 1 ikatan tripel (C≡N)
→ anggap ada 1s + 1p → orbital hibrida C adalah sp. - Atom N memiliki 1 ikatan tripel (ikatan C≡N) dan 1 ikatan singel (N–O)
→ anggap ada 1s + 1p → orbital hibrida N adalah sp. - Atom O memiliki 1 ikatan singel (ikatan O–N) dan 3 PEB
→ anggap ada 1s + 3p → orbital hibrida O adalah sp3.
Golongan unsur atom H = 1A, C = 4A, N = 5A, O = 6A. Tentukan orbital hibrida pada atom yang ditunjuk oleh setiap nomor pada gambar struktur molekul berikut:
Pembahasan #2:
Gambar struktur molekul soal ini tidak ditampilkan pasangan elektron bebas sebagaimana mestinya oleh karena itu untuk dapat menjawab secara benar harus memahami jumlah elektron valensi (ev) setiap atom. Elektron valensi dapat merujuk pada golongan setiap unsur.
Atom H memiliki ev = 1 (mampu membentuk 1 ikatan)
Atom C memiliki ev = 4 (mampu membentuk maksimal 4 ikatan)
Atom N memiliki ev = 5 (mampu membentuk maksimal 3 ikatan)
Atom O memiliki ev = 6 (mampu membentuk maksimal 2 ikatan)
- Atom H memiliki 1 ikatan singel (1 ikatan H–N), H tidak memiliki PEB
→ anggap ada 1s → orbital hibrida H adalah s. - Atom N memiliki 3 ikatan singel (2 ikatan N–H dan 1 ikatan N–H) karena N punya 5 ev ini berarti pada N mestinya punya 2 elektron atau 1 PEB (ingat setiap PEB = 2 ev) hanya pada gambar tidak ditampilkan. Jadi atom N ini punya 3 ikatan singel + 1 PEB = 4 orbital hibrida
→ anggap ada 1s + 3p → orbital hibrida N adalah sp3. - Atom O memiliki 1 ikatan dobel (1 ikatan O=C) karena O punya 6 ev ini berarti pada O sudah terpakai 2 ev, jadi masih tersisa 4 ev atau 2 PEB hanya pada gambar tidak ditampilkan. Jadi atom O ini punya 1 ikatan doble + 2 PEB = 3 orbital hibrida.
→ anggap ada 1s + 2p → orbital hibrida O adalah sp2. - Atom O memiliki 2 ikatan singel (1 ikatan O–C dan 1 ikatan O–H) karena O punya 6 ev ini berarti pada O sudah terpakai 2 ev, jadi masih tersisa 4 ev atau 2 PEB hanya pada gambar tidak ditampilkan. Jadi atom O ini punya 2 ikatan singel + 2 PEB = 4 orbital hibrida.
→ anggap ada 1s + 3p → orbital hibrida O adalah sp3. - Atom H memiliki 1 ikatan singel (1 ikatan H–O), H tidak memiliki PEB
→ anggap ada 1s → orbital hibrida H adalah s. - Atom C memiliki 4 ikatan singel (2 ikatan C–H, 1 ikatan C–N, 1 ikatan C–C) dan karena C hanya punya 4 ev maka tidak ada ev yang bebas = 4 orbital hibrida
→anggap ada 1s + 3p → orbital hibrida C adalah sp3. - Atom C memiliki 2 ikatan singel (1 ikatan C–O dan 1 ikatan C–C) dan 1 ikatan dobel (ikatan C=O) = 3 orbital hibrida
→ anggap ada 1s + 2p → orbital hibrida C adalah sp2.
- Khusus H → 1 ikatan → orbital hibrida s,
- Atom C, O, N dengan ikatan singel → orbital hibrida sp3.
- Atom C, O, N dengan 1 ikatan dobel → orbital hibrida sp2.
- Atom C, atau yang lain dengan 2 ikatan dobel → orbital hibrida sp.
- Atom C, N atau yang lain dengan 1 ikatan tripel → orbital hibrida sp.
Bagaimana dengan atom lain? Prinsipnya sama, yang perlu diperhatikan adalah berapa jumlah ikatan dan PEB pada atom tersebut, tidak perduli macamnya, mau ikatan singel/dobel/tripel tidak diperhatikan tetapi yang diperhatikan adalah jumlah ikatannya dan PEB saja.
Contoh Soal #3:
Apakah orbital hibrida pada atom yang ditunjuk pada gambar berikut?
Pembahasan #3:
Gambar struktur molekul soal ini tidak ditampilkan pasangan elektron bebas sebagaimana mestinya oleh karena itu untuk dapat menjawab secara benar harus memahami jumlah elektron valensi (ev) setiap atom. Elektron valensi dapat merujuk pada golongan setiap unsur.
Atom O memiliki ev = 6 (mampu membentuk maksimal 2 ikatan)
Atom S memiliki ev = 6 (mampu membentuk maksimal 6 ikatan)
- Atom O memiliki 2 ikatan singel (1 ikatan O–H dan 1 ikatan O–S) karena O punya 6 ev ini berarti pada O sudah terpakai 2 ev, jadi masih tersisa 4 ev atau 2 PEB hanya pada gambar tidak ditampilkan. Jadi atom O ini punya 2 ikatan singel + 2 PEB = 4 orbital hibrida.
→ anggap ada 1s + 3p → orbital hibrida O adalah sp3. - Atom O memiliki 1 ikatan dobel (1 ikatan O=S) karena O punya 6 ev ini berarti pada O sudah terpakai 2 ev, jadi masih tersisa 4 ev atau 2 PEB. Jadi atom O ini punya 1 ikatan doble + 2 PEB = 3 orbital hibrida.
→ anggap ada 1s + 2p → orbital hibrida O adalah sp2. - Atom S memiliki 2 ikatan singel (2 ikatan S–O) dan 2 ikatan dobel (2 ikatan S=O) karena S punya 6 ev ini berarti pada S sudah terpakai 6 ev, jadi tidak elektron tersisa atau 0 PEB. Jadi atom S ini punya 2 ikatan singel + 2 ikatan dobel = 4 orbital hibrida.
→ anggap ada 1s + 3p → orbital hibrida S adalah sp3.
Bagaimana menentukan orbital hibrida jika tidak diberikan gambar struktur molekulnya?
Kembali seperti bahasan sebelumnya, misal PH3 atau PCl3 orbital hibrida P adalah sp3, H dan Cl yang berikatan pada P tidak mungkin membentuk ikatan dobel atau tripel, semuanya membentuk ikatan singel. Ingat P itu berada pada golongan 5A (15) jadi punya 5 ev. Karena ada 3 ikatan singel berarti masih terdapat 1PEB, total ikatan dan PEB = 4 (1s + 3p) maka orbital hibrida atom P adalah sp3.
PCl5 apa orbital hibrida pada P? Semua Cl yang berikatan pada P adalah berikatan singel, jumlahnya sebanyak 5 ikatan singel, ingat 5 ikatan (1s + 3p + 1d) berarti orbital hibridanya adalah sp3d.
Demikian.


Tidak ada komentar:
Posting Komentar