Belerang (S, sulfur) mempunyai banyak senyawaan. Pada bahasan ikatan kimia kadang siswa ragu dalam menentukan ikatan kimia antara S dengan unsur lain, beserta hibridisasi dan bentuk molekul senyawaan S. Pada tulisan kali ini akan dibahas beberapa senyawaan S terkait bagaimana ikatan kimia, hibridisasi serta bentuk molekulnya. Bahasannya dibuat sederhana tanpa detil teori yang bagi siswa SMA akan sulit dimengerti.
Trik menentukan ada beberapa macam, misalnya dengan menggunakan rumus: jumlah orbital = ½ (V + X – K + A) sebagaimana pernah di kupas di sini, dan menggunakan hitungan semua elektron valensi atom dan muatan yang ada pada spesi yang akan ditentukan orbital hibridanya seperti yang pernah ditulis di sini. Untuk tulisan ini akan digunakan cara pertama itu.
Ingat atom yang termasuk monovalen: H, F, Cl, Br, I, dan O dalam peroksida.
Dengan tahu hibridisasi maka akan dapat ditentukan ikatan kimia antaratom dalam suatu spesi (molekul atau ion) dengan mudah dengan ketentuan yang pernah dibahas di sini. Selain itu dengan mengetahui hibridisasi dapat mula memperkirakan bentuk molekul atau geometri molekul seperti yang pernah dibahas di sini.
Pada bahasan khusus senyawaan atau ion yang mengandung atom S akan dibahas secara singkat. Harapannya agar dapat dijadikan rujukan awal bagi yang sedang mempelajari ikatan kimia, hibridisasi dan bentuk molekul. Dengan mengamati pola maka siapapun akan menemukan cara instan. Cara seperti ini dilakukan agar tidak menimbulkan keputusasaan dalam mempelajari ikatan kimia. Bila sudah paham cara instan berikutnya harus mempelajari secara detil agar pelajaran kimia tidak sekadar trik-cara instan saja.
Ketentuan jumlah orbital dan orbital hibridanya:
2 orbital, (1 orbital s + 1 orbital p) = orbital hibrida sp,
3 orbital, (1 orbital s + 2 orbital p) = orbital hibrida sp2,
4 orbital, (1 orbital s + 3 orbital p) = orbital hibrida sp3,
5 orbital, (1 orbital s + 3 orbital p + 1 orbital d) = orbital hibrida sp3d,
6 orbital, (1 orbital s + 3 orbital p + 2 orbital d) = orbital hibrida sp3d2,
7 orbital, (1 orbital s + 3 orbital p + 3 orbital d) = orbital hibrida sp3d3.
Konversi orbital hibrida ke bentuk molekul ion poliatom:
Catatan:
Untuk menghafal bentuk molekul dari bentuk dasar (geometri elektron) orbital hibrida sp3d, sp3d2, sp3d3, setiap 1 atom berikatan yang digantikan PEB, biasa yang tergantikan adalah atom yang berada pada posisi pembentuk bidang. Misal pada bentuk dasar bipiramida segitiga, yang tergantikan adalah atom yang berada pada pembentuk segitiga hingga semua tergantikan.
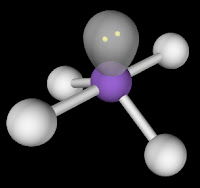
H2S
Atom pusat: S
Elektron valensi (V) S = 6
Jumlah atom monovalen (X) = 2
Jumlah muatan positif (K) = 0
Jumlah muatan negatif (A) = 0
Jumlah orbital terhibridisasi:
= ½ (6 + 2 – 0 + 0)
= ½ 8
= 4 → sppp → orbital hibrida sp3
PEB = jumlah orbital – jumlah atom sekitar
PEB = 4 – 2 = 2
Bentuk molekul:
tetrahedral terpancung 2 sudut = bengkok
SO
Atom pusat: S
Elektron valensi (V) S = 6
Jumlah atom monovalen (X) = 0
Jumlah muatan positif (K) = 0
Jumlah muatan negatif (A) = 0
Jumlah orbital terhibridisasi:
= ½ (6 + 0 – 0 + 0)
= ½ 6
= 3 → spp → orbital hibrida sp2
PEB = jumlah orbital – jumlah atom sekitar
PEB = 3 – 1 = 2
Bentuk molekul:
segitiga datar terpancung 2 sudut = linier
S2O
Atom pusat: S
Elektron valensi (V) S = 6
Jumlah atom monovalen (X) = 0
Jumlah muatan positif (K) = 0
Jumlah muatan negatif (A) = 0
Jumlah orbital terhibridisasi:
= ½ (6 + 0 – 0 + 0)
= ½ 6
= 3 → spp → orbital hibrida sp2
PEB = jumlah orbital – jumlah atom sekitar
PEB = 3 – 2 = 1
Bentuk molekul:
segitiga datar terpancung 1 sudut = bengkok
SO2
Atom pusat: S
Elektron valensi (V) S = 6
Jumlah atom monovalen (X) = 0
Jumlah muatan positif (K) = 0
Jumlah muatan negatif (A) = 0
Jumlah orbital terhibridisasi:
= ½ (6 + 0 – 0 + 0)
= ½ 6
= 3 → spp → orbital hibrida sp2
PEB = jumlah orbital – jumlah atom sekitar
PEB = 3 – 2 = 1
Bentuk molekul:
segitiga datar terpancung 1 sudut = bengkok
SO3
Atom pusat: S
Elektron valensi (V) S = 6
Jumlah atom monovalen (X) = 0
Jumlah muatan positif (K) = 0
Jumlah muatan negatif (A) = 0
Jumlah orbital terhibridisasi:
= ½ (6 + 0 – 0 + 0)
= ½ 6
= 3 → spp → orbital hibrida sp2
PEB = jumlah orbital – jumlah atom sekitar
PEB = 3 – 3 = 0
Bentuk molekul: segitiga datar
SO32–
Atom pusat: S
Elektron valensi (V) S = 6
Jumlah atom monovalen (X) = 0
Jumlah muatan positif (K) = 0
Jumlah muatan negatif (A) = 2
Jumlah orbital terhibridisasi:
= ½ (6 + 0 – 0 + 2)
= ½ 8
= 4 → sppp → orbital hibrida sp3
PEB = jumlah orbital – jumlah atom sekitar
PEB = 4 – 3 = 1
Bentuk molekul:
tetrahedral terpancung 1 sudut = piramida segitiga
SO42–
Atom pusat: S
Elektron valensi (V) S = 6
Jumlah atom monovalen (X) = 0
Jumlah muatan positif (K) = 0
Jumlah muatan negatif (A) = 2
Jumlah orbital terhibridisasi:
= ½ (6 + 0 – 0 + 2)
= ½ 8
= 4 → sppp → orbital hibrida sp3
PEB = jumlah orbital – jumlah atom sekitar
PEB = 4 – 4 = 0
Bentuk molekul: tetrahedral
S2O32–
Ini mirip dengan SO42– dengan 1 atom O diganti 1 atom S
Atom pusat: S
Elektron valensi (V) S = 6
Jumlah atom monovalen (X) = 0
Jumlah muatan positif (K) = 0
Jumlah muatan negatif (A) = 2
Jumlah orbital terhibridisasi:
= ½ (6 + 0 – 0 + 2)
= ½ 8
= 4 → sppp → orbital hibrida sp3
PEB = jumlah orbital – jumlah atom sekitar
PEB = 4 – 4 = 0
Bentuk molekul: tetrahedral
S2O82–
S2O82– dibagi 2 ion SO4–
2 ion SO4– yang terhubung dengan jembatan peroksida –O–O– yang diambil 1 atom O dari setiap SO4–. Karena O dalam peroksida berikatan sesama O maka ia dianggap sebagai monovalen. Bila O sendiri maka ia divalen.
Atom pusat (ada 2): S
Elektron valensi (V) S = 6
Jumlah atom monovalen (X) = 1
Jumlah muatan positif (K) = 0
Jumlah muatan negatif (A) = 1
Jumlah orbital terhibridisasi:
= ½ (6 + 1 – 0 + 1)
= ½ 8
= 4 → sppp → orbital hibrida sp3
PEB = jumlah orbital – jumlah atom sekitar
PEB = 4 – 4 = 0
Bentuk molekul: tetrahedral.
Jadi dalam S2O82– ini bentul molekulnya adalah 2 tetrahedral terhubung pada salah satu sudutnya.
SOCl2
Atom pusat: S
Elektron valensi (V) S = 6
Jumlah atom monovalen (X) = 2
Jumlah muatan positif (K) = 0
Jumlah muatan negatif (A) = 0
Jumlah orbital terhibridisasi:
= ½ (6 + 2 – 0 + 0)
= ½ 8
= 4 → sppp → orbital hibrida sp3
PEB = jumlah orbital – jumlah atom sekitar
PEB = 4 – 3 = 1
Bentuk molekul:
tetrahedral terpancung 1 sudut = piramida segitiga

SCl2
Atom pusat: S
Elektron valensi (V) S = 6
Jumlah atom monovalen (X) = 2
Jumlah muatan positif (K) = 0
Jumlah muatan negatif (A) = 0
Jumlah orbital terhibridisasi:
= ½ (6 + 2 – 0 + 0)
= ½ 8
= 4 → sppp → orbital hibrida sp3
PEB = jumlah orbital – jumlah atom sekitar
PEB = 4 – 2 = 2
Bentuk molekul:
tetrahedral terpancung 2 sudut = bengkok

SCl4
Atom pusat: S
Elektron valensi (V) S = 6
Jumlah atom monovalen (X) = 4
Jumlah muatan positif (K) = 0
Jumlah muatan negatif (A) = 0
Jumlah orbital terhibridisasi:
= ½ (6 + 4 – 0 + 0)
= ½ 10
= 5 → spppd → orbital hibrida sp3d
PEB = jumlah orbital – jumlah atom sekitar
PEB = 5 – 4 = 1
Bentuk molekul:
Bipiramida segitiga terpancung 1 sudut di equatorial = jungkat-jungkit
SF4
Atom pusat: S
Elektron valensi (V) S = 6
Jumlah atom monovalen (X) = 4
Jumlah muatan positif (K) = 0
Jumlah muatan negatif (A) = 0
Jumlah orbital terhibridisasi:
= ½ (6 + 4 – 0 + 0)
= ½ 10
= 5 → spppd → orbital hibrida sp3d
PEB = jumlah orbital – jumlah atom sekitar
PEB = 5 – 4 = 1
Bentuk molekul:
Bipiramida segitiga terpancung 1 sudut di equatorial = jungkat-jungkit
SF6
Atom pusat: S
Elektron valensi (V) S = 6
Jumlah atom monovalen (X) = 6
Jumlah muatan positif (K) = 0
Jumlah muatan negatif (A) = 0
Jumlah orbital terhibridisasi:
= ½ (6 + 6 – 0 + 0)
= ½ 12
= 6 → spppdd → orbital hibrida sp3d2
PEB = jumlah orbital – jumlah atom sekitar
PEB = 6 – 6 = 0
Bentuk molekul: oktahedral
Gambar pada tulisan ini dibuat dengan tangkap layar dari simulator molecule-shapes dari Phet Colorado. Warna tidak menunjukkan warna atom yang sesungguhnya, hanya sekadar membedakan atom pusat dengan atom sekitar.
Demikian pembahasan tentang ikatan kimia, hibridisasi, dan bentuk molekul dari senyawaan S.










Tidak ada komentar:
Posting Komentar