Sebagai rangkaian dalam menggambar struktur Lewis yang benar mungkin cara berikut dapat dijadikan alternatif yaitu cara menghitung jumlah ikatan rangkap pada suatu struktur molekul menurut cara Lewis. Berharap nanti rangkaian ini akan menjadi satu kesatuan yang utuh dengan rangkaian yang pernah dibahas dalam web ini sehingga siswa dapat memastikan diri bahwa "ternyata menggambar struktur Lewis itu tidak sulit", tidak malah jadi bingung, mereka dapat memastikan gambar yang dibuatnya adalah benar. Ok! Jumlah elektron π adalah jumlah elektron yang digunakan untuk berikatan rangkap/dobel (double bond) atau berikatan rangkap tiga/tripel (triple bond).
Dalam bahasan ini nanti hasil hitung jumlah elektron π bisa saja menjadi elektron bebas (sebagai pasangan elektron bebas (PEB)) untuk menyesuaikan keadaan :)
Jumlah elektron π = 6n + 2 - ev (atom pusat berada pada periode 2)
Jumlah elektron π = 6n + 4 - ev (atom pusat P)
Jumlah elektron π = 6n + 6 - ev (atom pusat S)
Jumlah elektron π = 6n + 8 - ev (atom pusat Cl)
n = jumlah atom dalam molekul atau ion, khusus atom H tidak turut dihitung.
ev = total elektron valensi atom-atom dalam molekul atau ion.
Jumlah elektron π = 6n + 4 - ev (atom pusat P)
Jumlah elektron π = 6n + 6 - ev (atom pusat S)
Jumlah elektron π = 6n + 8 - ev (atom pusat Cl)
n = jumlah atom dalam molekul atau ion, khusus atom H tidak turut dihitung.
ev = total elektron valensi atom-atom dalam molekul atau ion.
Bila jumlah elektron π = 2 → 1 ikatan dobel
Bila jumlah elektron π = 4 → 2 ikatan dobel atau 1 ikatan tripel atau terdapat PEB
Bila jumlah elektron π = 6 → 3 ikatan dobel atau 2 ikatan tripel atau terdapat PEB
Untuk molekul dengan atom pusat dari periode 2 (O, N, C) kebanyakan akan mengikuti aturan oktet dan hanya pada beberapa molekul saja yang kadang tidak mengikuti aturan oktet seperti BF3 dan NO. Sementara itu untuk atom pusat yang berada pada periode ketiga (jumlah kulit 3) kebanyakan tidak mengikuti aturan oktet.
C2H2
n → 2 (2C, atom H tidak dihitung)
Σ ev = 2 ev C + 2 ev H
Σ ev = 2×4 + 2 1
Σ ev = 8 + 2
Σ ev = 10
Jumlah elektron π = 6n + 2 - ev
Jumlah elektron π = 6×2 + 2 - 10
Jumlah elektron π = 4 (2 ikatan dobel atau 1 ikatan tripel atau terdapat PEB)
Pada C2H2 terdapat 1 ikatan tripel di C sebagai atom pusat.
Karena yang mungkin hanyalah 2 atom C maka untuk 2 ikatan dobel menjadi tidak mungkin sehingga antara C dengan C terdapat 1 ikatan tripel.
H2SO4
n → 5 (1S dan 4O, atom H tidak dihitung)
Σ ev = 2 ev H +1 ev S + 4 ev O
Σ ev = 2 + 6 + 4×6
Σ ev = 2 + 6 + 24
Σ ev = 32
Jumlah elektron π = 6n + 6 - ev
Jumlah elektron π = 6×5 + 6 - 32
Jumlah elektron π = 4 elektron (2 ikatan dobel atau 1 ikatan tripel atau terdapat PEB)
Pada H2SO4 terdapat 2 ikatan dobel di S sebagai atom pusat.
H2SO3
n → 4 (1S dan 3O, atom H tidak dihitung)
Σ ev = 2 ev H +1 ev S + 3 ev O
Σ ev = 2 + 6 + 3×6
Σ ev = 2 + 6 + 18
Σ ev = 26
Jumlah elektron π = 6n + 6 - ev
Jumlah elektron π = 6×4 + 6 - 26
Jumlah elektron π = 4 elektron (2 ikatan dobel atau 1 ikatan tripel atau terdapat PEB)
Pada H2SO3 terdapat 1 ikatan dobel dan 2 elektron bebas (1 PEB) di S sebagai atom pusat.
SO2
n → 3 (1S dan 2O)
Σ ev = 1 ev S + 2 ev O
Σ ev = 6 + 2×6
Σ ev = 6 + 12
Σ ev = 18
Jumlah elektron π = 6n + 6 - ev
Jumlah elektron π = 6×3 + 6 - 18
Jumlah elektron π = 6 elektron (3 ikatan dobel atau 2 ikatan tripel atau terdapat PEB)
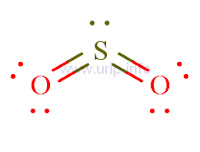
Pada SO2 ini terdapat 2 ikatan dobel dan 2 elektron bebas (1 PEB).
SO3
n → 4 (1S dan 3O)
Σ ev = 1 ev S + 3 ev O
Σ ev = 6 + 3×6
Σ ev = 6 + 18
Σ ev = 24
Jumlah elektron π = 6n + 6 - ev
Jumlah elektron π = 6×4 + 6 - 24
Jumlah elektron π = 6 elektron (3 ikatan dobel atau 2 ikatan tripel atau terdapat PEB)
Pada SO3 ini terdapat 3 ikatan dobel.
HClO4
n → 5 (1Cl dan 4O, atom H tidak dihitung)
Σ ev = 1 ev H +1 ev Cl + 4 ev O
Σ ev = 1 + 7 + 4×6
Σ ev = 1 + 7 + 24
Σ ev = 32
Jumlah elektron π = 6n + 8 - ev
Jumlah elektron π = 6×5 + 8 - 32
Jumlah elektron π = 6 elektron (3 ikatan dobel atau 2 ikatan tripel atau terdapat PEB)
Pada HClO4 terdapat 3 ikatan dobel.
HClO2
n → 3 (1Cl dan 2O, atom H tidak dihitung)
Σ ev = 1 ev H +1 ev Cl + 2 ev O
Σ ev = 1 + 7 + 2×6
Σ ev = 1 + 7 + 12
Σ ev = 20
Jumlah elektron π = 6n + 8 - ev
Jumlah elektron π = 6×3 + 8 - 20
Jumlah elektron π = 6 elektron (3 ikatan dobel atau 2 ikatan tripel atau terdapat PEB)
Pada HClO2 terdapat 1 ikatan dobel dan 4 elektron bebas (2 PEB)
PCl3
n → 4 (1P dan 3Cl)
Σ ev = 1 ev P + 3 ev Cl
Σ ev = 5 + 3×7
Σ ev = 5 + 21
Σ ev = 26
Jumlah elektron π = 6n + 4 - ev
Jumlah elektron π = 6×4 + 4 - 26
Jumlah elektron π = 2 (1 ikatan dobel atau e elektron bebas)
Pada PCl3 terdapat elektron bebas, tanpa ikatan dobel.
PCl5
n → 6 (1P dan 5Cl)
Σ ev = 1 ev P + 5 ev Cl
Σ ev = 5 + 5×7
Σ ev = 5 + 35
Σ ev = 40
Jumlah elektron π = 6n + 4 - ev
Jumlah elektron π = 6×6 + 4 - 40
Jumlah elektron π = 0 elektron
Pada PCl5 tidak terdapat ikatan dobel
H3PO4
n → 5 (1P dan 4O, atom H tidak dihitung)
Σ ev = 3 ev H + 1 ev P + 4 ev O
Σ ev = 3×1 + 5 + 4×6
Σ ev = 3 + 5 + 24
Σ ev = 32
Jumlah elektron π = 6n + 4 - ev
Jumlah elektron π = 6×5 + 4 - 32
Jumlah elektron π = 2 elektron (1 ikatan dobel atau e elektron bebas)
Pada H3PO4 terdapat 1 ikatan dobel.
CH3COOH
n → 4 (2C dan 2O, atom H tidak dihitung)
Σ ev = 2 ev C + 4 ev H + 2 ev O
Σ ev = 2×4 + 4×1 + 2×6
Σ ev = 8 + 4 + 12
Σ ev = 24
Jumlah elektron π = 6n + 2 - ev
Jumlah elektron π = 6×4 + 2 - 24
Jumlah elektron π = 2 elektron (1 ikatan dobel atau e elektron bebas)
Pada CH3COOH terdapat 1 ikatan dobel.
Demikian, jika ada yang kurang tepat senang untuk mendapat koreksi untuk perbaikan. Terima kasih.










Tidak ada komentar:
Posting Komentar